A. 항혈소판제
•
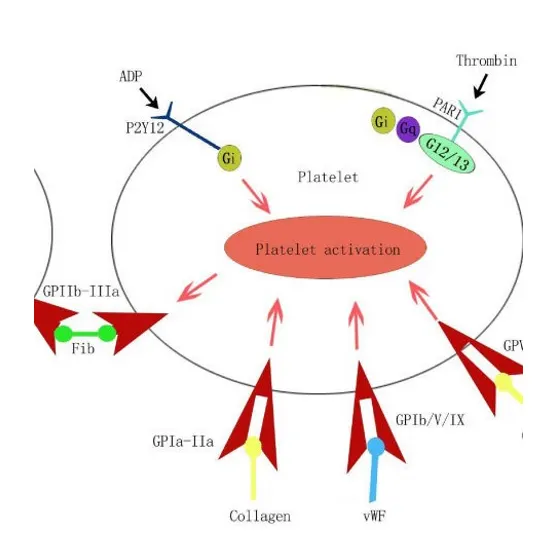
PLT 응집의 기전
ADP와 purinergic P2Y12 receptor 상호작용
→ GP IIb/IIIa 활성화 유발 및 유지
→ 활성화된 GP IIb/IIIa 수용체를 통해 fibrin을 매개로 PLT가 서로 응집함
A1. Anti PLT의 종류
•
TXA2 억제제- Aspirin
•
P2Y12 수용체 억제제
•
GP IIa/IIIb 억제제
(1) 표준치료
Dual antiplatelet therapy (DAPT) : Aspirin + P2Y12 수용체 억제제
•
가장 표준적 치료임.
•
대체로 1년간 유지 권고
•
3개월 DAPT 유지 후 P2Y12 수용체 억제제 단독사용 or 1개월 후 프라수그렐 용량 감소
•
허혈/출혈 위험도 함꼐고려한 점수체계로 P2Y12 수용제 억제제 강도결정
•
어떤 P2Y12를 어느 기간동안 사용하냐가 AMI에서 Anti-PLT 치료의 핵심이다.
(2) 1세대 P2Y12 수용체 억제제
•
Ticlopidine, 부작용으로 2세대로 대체.
(3) 2세대 P2Y12 수용체 억제제
•
Clopidogrel (Plavix) : 전구약물. 85%는 불활성화, 15%는 cytochrome p450체계에 의해 2단계 산화과정으로 활성화 --> P2Y12 수용체와 비가역적 결합.
•
Onset느림.
•
CYP2C19와 CYP3A4/5 효소의 유전자 변이 있는 경우, 환자상태, 약물상호작용에 따라 효과 차이
•
스텐트 혈전증 및 기타 허혈성 임상사건 발생위험 증가
•
한국인은 클로피도그렐 유전자형 범위가 더 많지만 출혈위험이 서구인보다 더 높고 허혈위험이 더 낮음
•
P2Y12 수용체 억제제가 나온 이후로는 GP IIb/IIIa 억제제(Abciximab)는 혈전성 합병증이나 긴급상황에서 선택적으로만 사용
(4) 3세대 P2Y12 수용체 억제제
•
출혈 합병증은 약간 더 증가, but 허혈성 심장사건을 유의하게 감소
•
시술직전 혹은 직후에 하더라도 예후에 큰 영향 없다.
: 다른 질환으로 인한 cardiac marker상승으로 CAG하는 환자에게 불필요한 loading 감소
•
Prasugrel (Effient) : 전구약물. 장에서 흡수. 70%가수분해-->R95913으로 대사 --> 간에서 1단계 산화과정 --> 30분 내 활성화 --> clopidogrel보다 15~30 배의 생체이용률
◦
STEMI에서는 시술전 60 mg loading
◦
NSTEMI에서는 PCI하는 경우에 한하여 loading
◦
금기 : 75세 이상, 60kg미만, TIA (stoke 등) Hx.
◦
표준치료 : 하루 10mg 1년
◦
저용량 치료 : 1달간 표준용량, 이후 11개월 간 5mg으로 감량
•
Ticagrelor (Brillinta) : 중간대사과정없이 가역적으로 PLT 기능 억제
◦
시술 전 180mg loading --> 90 mg 매일 2회
◦
한국인에서는 clopidogrel 75mg 하루 1회 용법보다 출혈위험 2배
◦
2020 유럽지침에서는 Prasugrel을 더 선호
•
허혈사건에 대한 잔여 위험도 높은 군에서는 강력한 항혈전 치료 권고
: DM, AMI 재발, multivessel dz, 말초동맥질환동반, CKD
: DAPT 1년 이상 유지 or rivaroxaban 같은 항응고제 저용량(2.5 mg) 추가.
B. 베타차단제
B1. 적응증
•
EF < 40% 의 심부전
•
좌심실 기능저하
B2. 금기
•
급성 심부전
•
심인성쇼크
•
PR interval 0.24초 이상
•
2 or3 도 방실차단
•
급성천식발작
•
속효성 메토프롤롤 아테놀롤, 프로프라놀롤 - 예후개선효과 없다.
•
bisoprolol, carvediliol, metoprolol extend elease, nebivolol
•
휴식시 HR 55 -60 bpm 목표
•
좌심실기능저하정도와 투여기간에따라 심근경색환자에서 임상적효과의 차이가 있다.
C. LDL 저하제
C1. 스타틴
•
콜레스테롤 전구체인 HMG-CoA (3-hydroxy-3-methylglutaryl coenzyme A)의 환원효소를 경쟁적으로 억제하여 간의 콜레스테롤을 줄이며 특히 LDL-C를 주로 감소시키는 약제
C2. 에제티미브(ezetimibe)
•
장과 간의 순환을 통해 내인성 콜레스테롤이 소장에 재흡수되는 것을 방해하여 주로 LDL-C를 15-20% 정도 감소시킨다.
•
2020년 대한심근경색증연구회 전문가 합의문에서는 초기에 고강도 스타틴 치료를 권고하고, 치료목표를 기저 수준의 50% 이상 감소 및 70 mg/dL 이하로 유지하도록 하였다
•
스타틴은 용량 두 배 증량하더라도 6% 정도만 더 LDL-C가 저하되기 때문에 저강도 또는 중강도 스타틴에 에제티미브를 함께 처방하는 것이 LDL-C 저하효과는 더 클 가능성이 크다
•
스타틴 용량 증량에 따른 부작용을 줄일 수도 있고 국내 환자는 외국인보다 스타틴의 LDL-C 저하효과가 더 크기 때문에 초기에 에제티미브 복합요법도 합리적인 선택일 가능성이 있다.
•
2018년 한국지질·동맥경화학회 지침에서 LDL-C를 70 mg/dL 미만 혹은 기저수치의 50% 이상 감소시키도록 하는 LDL-C 치료목표를 설정. 스타틴을 최대 가용 용량을 사용함에도 목표 수치를 달성하지 못하면 에제티미브와 PCSK-9 억제제 투여를 권고.
D. 레닌-안지오텐신-알도스테론 억제제
D1. ACEI
(1) 적응증
•
좌심박출률이 40% 이하의 심부전
•
당뇨병, 고혈압, CKD 등의 동반질환 있는 경우
•
ACEI 불내성이 있는 경우 --> ARB 사용 권고
•
STEMI 에서는 ACEI 를 좌심기능저하가 없더라도 되도록 사용하도록 권고
: ACEI 불내성이 있을 때 ARB를 권고하고 있지는 않다.
(2) 금기증
•
고칼륨혈증을 동반한 심한 신기능장애
D2. 알도스테론 수용체 차단제
•
베타차단제와 ACEI 투여하는 환자에서 EF < 40% 인 경우 추가적 사용을 권고
•
신장기능장애(Cr >2.5 mg/dL 남성 또는 >2.0 mg/dL 여성 혹은 eGFR 45 mL/min/1.73㎡)나 고칼륨혈증(>5.0 mEq/L)이 있는 경우 유의해서 사용해야 한다
•
발살탄, 칸데르살탄, 텔미사탄, 올메사탄을 많이 사용함 (비경쟁적)