A1. 투여대상
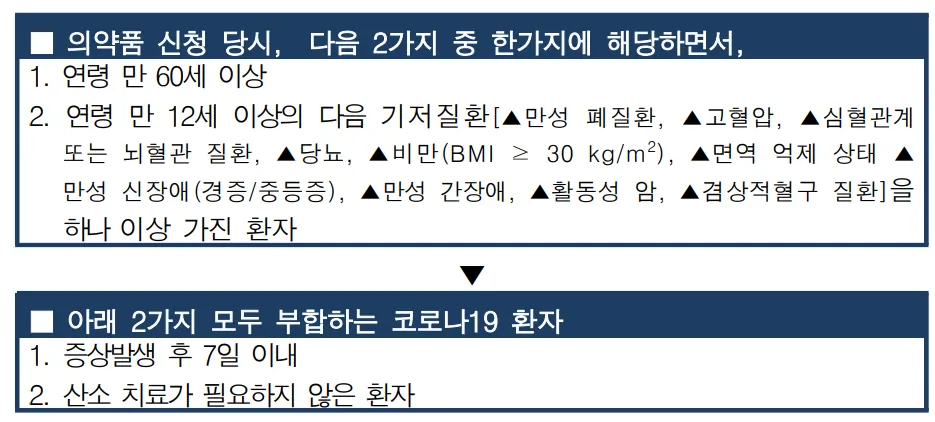
(1) 투여대상 1 : 치료제 처방 당시, 아래 기준을 충족하는 중증 또는 폐렴 환자
아래 한 가지 이상에 해당
•
CXR 또는 CT에서 폐렴소견
•
Room air SPO2 < 94%
•
산소치료 시행 (Low flow, High flow) - Vent나 ECMO는 제외
(2) 투여대상 2 : 치료제 처방 당시, 아래 기준을 충족하는 경증‧중등증 환자
A2. 용량, 용법
(1) 투여 전 및 투여기간 중 검사
•
이 약을 투여하기 전에 간기능 및 신기능(eGFR 또는 혈청 크레아티닌) 검사를 실시하
여 투여 여부를 판단한다. 이 약 투여 기간 중에도 매일 간기능 및 신기능을 모니터링하여, 이 약의 투여 지속 여부를 평가한다.
(2) 권장 투여 용량
•
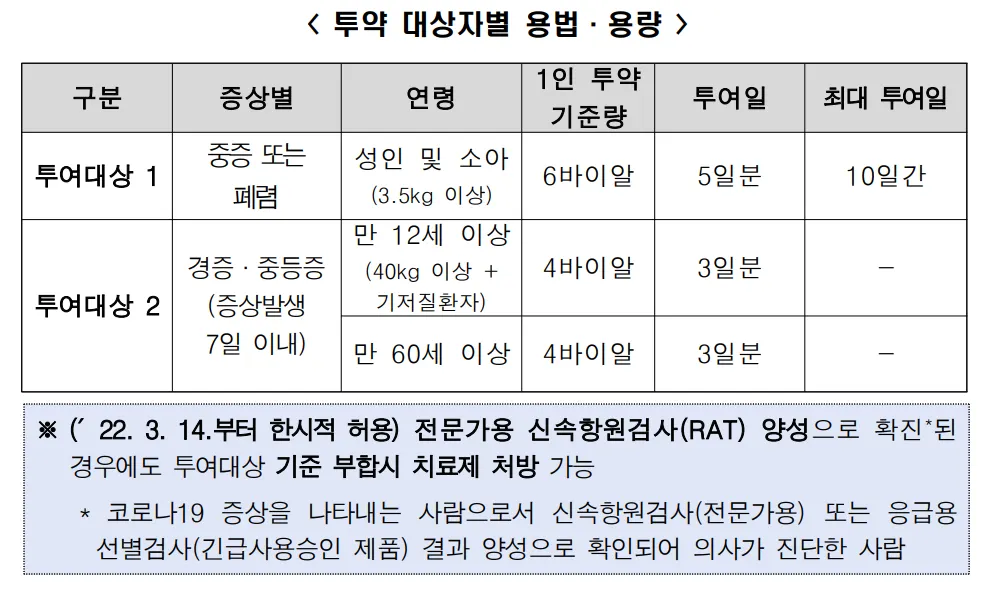
성인
1인 투약 기준량 - 기본 4 Vial (3일분)
권장용량은 첫째 날 200 mg 투여(부하용량) 후, 둘째 날부터 100 mg 투여(유지용량)
•
소아
소아에서 코로나바이러스감염증-19(이하 코로나19)에 대한 이 약의 치료 효과는 평가된
바 없으며, 소아에서의 약동학 정보는 없다. 소아에서의 권장 용량은 건강한 성인에서의 약
동학 정보를 바탕으로 생리학 기반 약물동태(PBPK; Physiologically Based
pharmacokinetic) 모델링을 통해 산출되었다. 이 약을 투여하여 기대되는 임상적 유익성이
위해성을 상회하는 경우에만 이 약을 투여한다(사용상의 주의사항 ‘8. 소아 및 고령자에
대한 투여’항 참조).
•
l 체중 40 kg 이상의 소아: 이 약의 권장용량은 첫째 날 200 mg 투여(부하용량) 후, 둘째 날부터 100 mg 투여(유지용량)이다. l 체중 3.5 kg 이상 40 kg 미만의 소아: 이 약의 권장용량은 첫째 날 5 mg/kg 투여
(부하용량) 후, 둘째 날부터 2.5 mg/kg(유지용량) 투여이다. 40 kg 미만의 소아에
게는 주사용 동결건조분말만을 사용해야 하며, 주사용 액제는 사용해서는 안된다.
기본 6 vial (5 일 분) 투여
첫 날 200 mg → 둘째 날 부터 100 mg (성인기준)
바이러스 장기증식 예상되는 경우 10일까지 (11 vial)
(3) 투여 방법
•
30분에서 120분에 걸쳐 1일 1회 IV infusion). IM 하지 않는다. 이 약은 보존제를 함유하지 않는다. 단회 용량 바이알의 미사용 부분은 희석 용액을 조제한후 폐기하여야 한다
1.
신장애 환자
투여 전 및 투여기간 동안 매일 eGFR 또는 혈청 Cr (생후 7일 이상 28일 이하의 만삭신생아) 측정
•
eGFR, 남성: (140 – 나이) ×(체중(kg)) / 72 ×(혈청 크레아티닌(mg/dL)) - eGFR, 여성: (140 – 나이) ×(체중(kg)) ×0.85 / 72 × (혈청 크레아티닌 (mg/dL))
•
소아 (28일 이상 1세 미만)
•
eGFR: 0.45 × (신장(cm)) / 혈청 크레아티닌(mg/dL)
l 소아 (1세 이상 18세 미만)
•
eGFR = 0.413 x (신장(cm))/Scr) 또는 41.3 x (신장(m))/Scr)
1.
이 약에 포함된 부형제 베타덱스설포부틸에테르나트륨(sulphobutyl Ether β
-cyclodextrin sodium; SBECD)은 신장을 통해 제거되고 신기능이 저하된 환자들에서 축
적되므로, 잠재적 이익이 잠재적 위험을 상회하지 않는 한 eGFR이 30 mL/min 미만인 성
인과 소아 환자(생후 28일 초과) 또는 혈청 크레아티닌 청소율이 1 mg/dL 이상인 만삭신
생아(생후 7일 이상 28일 이하)에서 이 약의 투여는 권장되지 않는다.
2. 간장애 환자
1.
간장애 환자에서 용량 조절의 필요성 여부는 확인되지 않았다. 잠재적 이익이 잠재적 위
험을 상회하는 경우에만 이 약을 사용한다(사용상의 주의사항 ‘1. 경고’, ‘3. 다음 환자에
게는 신중하게 투여할 것’ 및 ‘9. 간장애 환자에서의 사용’ 참조).
2.
이 약 투여 전 및 투여기간 동안 매일 간기능 검사(실험실적 검사)를 실시한다.